Реактивы для определения индола.
Реактивы для определения индола.
Реактив Эрлиха.
1 г пара-диметиламинобензальдегида растворяют в 95 см3 96°-ного этилового спирта и добавляют 20 см3 соляной кислоты. Реактив хранят без доступа света.
Реактив Ковача.
5 г пара-диметиламинобензальдегида растворяют в 75 см3 амилового спирта при нагревании на водяной бане при температуре 50—55 °С, охлаждают и добавляют 25 см3 концентрированной соляной кислоты. Реактив имеет желтую окраску, хранят его в холодильнике при температуре 4 °С.
Для определения индола к 1 —2-суточной бульонной культуре добавляют 1 — 1,5 см3 эфира для экстрагирования индола, встряхивают, затем осторожно по стенке вносят 7 — 10 капель реактива, при положительной реакции на границе эфира и бульона появляется ярко-малиновое окрашивание. Сущность реакции заключается в том, что индол (ортобензопиррол), образующийся при расщеплении триптофана, вступает в химическую реакцию с кислотно-спиртовым раствором пара-диметилбензальдегида и дает розовое или красное окрашивание.
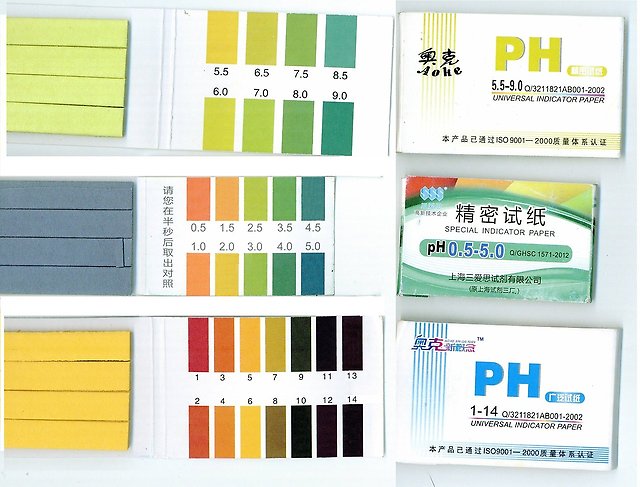 Индикаторная бумага для определения индола.
Индикаторная бумага для определения индола.
Вариант 1. 5г пара-диметиламинобензальдегида, 10 см3 очищенной концентрированной ортофосфорной кислоты растворяют в 50 см3 метилового спирта. В тепловатом растворе смачивают фильтровальную бумагу; высушивают, нарезают узкими полосками размером 0,5 х 6 см. Цвет бумаги светло-желтый, при наличии индола изменяется от синевато-розового до интенсивно малинового. Появление других окрасок на индикаторной бумаге не учитывают.
Вариант 2. Фильтровальную бумагу пропитывают насыщенным (10 %-ным водным) раствором щавелевой кислоты, высушивают, разрезают на полоски. Цвет бумаги — белый со слабым желтоватым оттенком.
При наличии индола нижняя часть индикаторной бумажки окрашивается в розовый цвет (просматривать при проходящем свете); при обильном образовании индола наблюдается розовая окраска всей полоски.
Вариант 3. Фильтровальную бумагу пропитывают реактивом Ковача; при наличии индола появляется розовый и красный цвет.
Можно рекомендовать рациональный способ изготовления ”индольных” бумажек. Для этого фильтровальную бумагу разрезают на 5—6 листов размером 25 х 15 см, свертывают каждый вдоль пополам и опускают перпендикулярно в реактив, налитый в кювету, смочив бумагу на 3—4 см. Сушат бумагу при комнатной температуре в течение 2—3 ч, развесив на бельевой веревке. Затем согнутую часть срезают ножницами, а обе получившиеся полоски свертывают в рулон, от которых перед употреблением отрезают необходимое количество индикаторных бумажек и закрепляют чистым концом под пробирку с посевом тест-культур.
Индикаторная бумага для определения сероводорода.
В 100 см3 дистиллированной воды растворяют 20 г ацетата свинца и 1 г гидрокарбоната натрия и пропитывают полоски фильтровальной бумаги. После приготовления бумага остается белой; при наличии сероводорода нижняя часть индикаторной бумажки приобретает черно-бурый цвет, иногда с металлическим блеском. В настоящее время "сероводородные" бумажки изготавливаются промышленностью.
Способность микроорганизмов расщеплять белки среды до индола и сероводорода можно устанавливать в мясо-пептонном бульоне, пептонной воде, но лучше — в бульоне Хоттингера.
 Индикатор бромтимоловый синий.
Индикатор бромтимоловый синий.
0,4 г бромтимолового синего растворяют в 40 см3 дистиллированной воды, нагревая до кипения, затем добавляют 6,4 см3 0,1 н. раствора гидроксида натрия, в результате жидкость становится зеленоватого цвета, и доводят дистиллированной водой до 100 см3.
Индикатор может сохраняться долго в банке из темного стекла, закрытой притертой пробкой.
Бромтимоловый синий позволяет определить изменение реакции в пределах pH 6,0—7,6. При pH 7,6 индикатор имеет синий цвет, при 6,0 — желтый. В пределах pH от 6,0 до 7,6 окраска изменяется через различные оттенки зеленого цвета; в нейтральной среде (pH 7,0) индикатор имеет характерный травянистый оттенок.
Индикатор розоловая кислота.
1 г розоловой кислоты растворяют в 500 см3 этилового спирта. Если раствор желтого цвета, добавляют несколько капель 0,1 н. раствора гидроксида натрия до появления красновато-оранжевого оттенка.
В кислой среде индикатор имеет лимонно-желтый цвет, в щелочной — розово-красный; переходная зона pH 6,8—7,0.
Индикатор Андреде.
0,5 г кислого фуксина растворяют в 100 см3 дистиллированной воды и добавляют 15 — 18 см3 1 н. раствора гидроксида натрия, перемешивают и выдерживают при комнатной температуре течение 24 ч, периодически встряхивая — цвет индикатора изменяется от красного до коричневого, при отсутствии изменения окраски вносят до 1 см3 щелочи и оставляют на 24 ч.
В лабораторной практике часто готовят индикатор по другой прописи: 0,5 т фуксина растворяют в 16,4 см3 1 н. раствора гидроксида натрия (4 %-ный раствор) , прибавляют 100 см3 дистиллированной воды, отстаивают в термостате при температуре 37 °С в течение 24 ч и затем в течение 48 ч при комнатной температуре на свету.
Готовый индикатор имеет желтый цвет с коричневым оттенком, напоминающим цвет чая, В кислой среде приобретает ярко-малиновую краску.
Приготовленный таким образом индикатор сохраняют во флаконах из темного стекла с притертой пробкой в обычных условиях.
Индикатор для обнаружения фермента оксидазы (цитохромоксидазы) у аэробных микроорганизмов.
По Эрлиху.
30—40 мг альфа-нафола растворяют в 2,5 см3 этилового спирта-ректификата, добавляют ,5 см3 дистиллированной воды и растворяют 40 60 мг пара-диметилоенилендиамина.
Для определения оксидазы на поверхность 18—20-часовой агароной культуры наносят 1—2 капли индикатора, при положительной реакции через 1—3 мин появляется ярко-синее окрашивание в результате образования индофенола синего.
С целью определения этого фермента у культур можно пользоваться СИБ (стандарты индикаторные бумажные), выпускаемыми Горьковским НИИ эпидемиологии и микробиологии (в соответствии с наставлением).
По Ковачу.
1 г пара-тетраметилфенилендиамина растворяют в 100 см3 дистиллированной воды.
Для определения фермента на поверхность суточной агаровой культуры наносят несколько капель реактива, при положительной реакции через 20—30 с культура окрашивается в темно-красный цвет, обусловленный образованием вурстеровского синего.
Тест-реактивы для выявления редукционной активности бактерий.
Раствор А: при слабом нагревании растворяют 0,8 г сульфониловой кислоты в 100 см3 уксусной кислоты (5 н. раствор).
Раствор Б: растворяют 0,5 г альфа-нафтиламина и 0,6 г диметил-альфа-нафтиламина при подогревании в 100 см3 уксусной кислоты (5 н. раствор) .
Реактивы токсичны. Их хранят в банках из темного стекла с притертыми пробками в холодильнике при температуре +4 °С в течение 2 — 3 мес (при периодическом контроле).
Для определения редукционной активности в питательную среду, содержащую нитрат калия, вносят одну петлю суточной агаровой культуры и выдерживают в термостате при температуре +37 °С в течение 4 сут.
Способность редуцировать нитраты в нитриты определяют добавлением через 8 —10 ч инкубирования культуры по 1 см3 растворов А и Б; при положительной реакции через несколько минут содержимое пробирки приобретает красный цвет, при отрицательной — окраска среды не изменяется, в этом случае наблюдение проводят в течение 4 сут с целью выявления замедленной редукционной активности, Для подтверждения отрицательного результата в пробирку с культурой вносят небольшое количество цинковой пыли — под влиянием ионов цинка нитраты восстанавливаются в нитриты и появляется красное окрашивание.
 Индикатор метиловый красный
Индикатор метиловый красный
О.1 г метилового красного растворяют в 300 см3 96°-ного этилового спирта, затем добавляют 200 см3 дистиллированной воды.
Постановка реакции: к 2 см3 испытуемой культуры, выращенной на среде Кларка при температуре +37 или +22 °С в течение 2—5 сут, добавляют 5—6 капель индикатора; при положительной реакции среда становится ярко-красной, так как ферментация глюкозы сопровождается образованием смеси кислот (молочной, уксусной, муравьиной и др.), в результате рН среды сдвигается в кислую сторону до 4,0—5,0. При отрицательной реакции среда имеет желтый цвет. Индикатор предназначен для проведения реакции на ферментацию глюкозы.
Индикатор для реакции Фогес—Проскауэра.
Тест-реактив состоит из 2 отдельных ингредиентов: 6%-ного спиртового раствора альфа-нафтола (30 г альфа-нафтола растворяют в 500 см3 96°-ного этилового спирта) и 40 %-ного раствора гидроксида калия (120 г КОН растворяют в 300 см3 дистиллированной воды).
Постановка реакции: к 2,5 см3 2—5-суточной культуры, выращенной на среде Кларка, добавляют в строгой последовательности 1 см3 раствора альфа-нафтола, затем 0,4 см3 40 %-ной КОН; при положительной реакции в верхней части среды появляется красное окрашивание. Сущность реакции заключается в том, что при расщеплении глюкозы образуется промежуточный продукт ацетоин (ацетилметилкарбинол), который в присутствии щелочи и альфа-нафтола (катализатора) окисляется до диацетила, дающего с пептоном среды и КОН цветную реакцию.