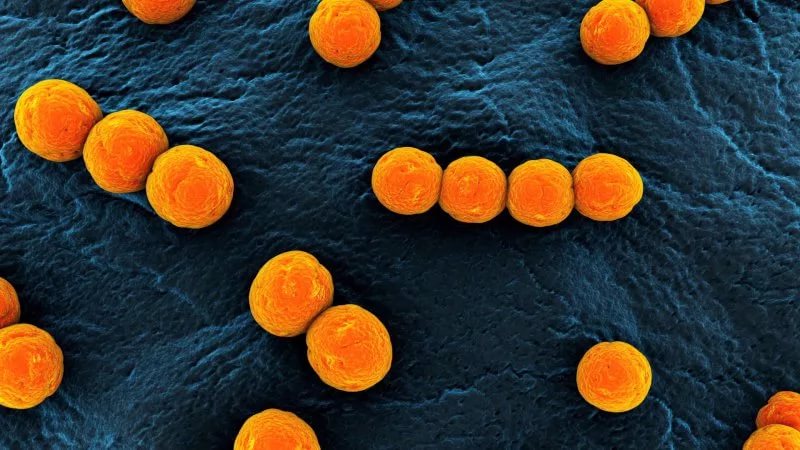
 Обнаружение в мясе возбудителей коккозов (стрептококков, пневмококков, стафилококков) проводится в 3 этапа:
Обнаружение в мясе возбудителей коккозов (стрептококков, пневмококков, стафилококков) проводится в 3 этапа:
микроскопия мазков-отпечатков; выделение культур из материала, их идентификация и дифференциация; изучение патогенных свойств выделенных культур.
Морфологические и культуральные свойства. При микроскопии мазков-отпечатков, окрашенных по Граму, а при подозрении на наличие в мясопродуктах пневмококков — на капсулу по Ольту обнаружение большого количества грамположительных кокков, круглых или ланцетовидных, расположенных одиночно, по два, цепочками и скоплениями, позволяет предполагать стрептококковую инфекцию. Однако микроскопическое исследование имеет ориентировочное значение.
Посевы из патологического материала делают в мясо-пептонный бульон с 1 % глюкозы и 10 % инактивированной нормальной сыворотки крови лошади и на мясо-пептонный агар с 1 % глюкозы и 5 —10 % дефибринированной крови барана или кролика. Посевы инкубируют в термостате при 37—38 °С в течение 18—24 ч.
На глюкозокровяном агаре стрептококки растут в виде мелких росинчатых или слегка мутноватых колоний с ровными краями, окруженных, как правило, зоной гемолиза; стафилококки образуют круглые выпуклые блестящие колонии, различного (белого, лимонно-желтого, золотистого) цвета; пигмент хорошо выражен на МПА.
По характеру гемолиза стрептококки делят на три группы:
альфа-гемолитические стрептококки — вызывают неполный гемолиз эритроцитов, сопровождающийся образованием вокруг колоний зоны зеленоватого цвета;
бетта-гемолитические стрептококки — вызывают полный гемолиз эритроцитов , характеризующийся образованием вокруг колоний зоны просветления;
гамма-стрептококки — не вызывают гемолиза эритроцитов.
Патогенные стафилококки на кровяном агаре вызывают альфа-гемолиз.
В мазках из культур с плотной питательной среды стрептококки располагаются парами, короткими цепочками, иногда образуют скопления, стафилококки — гроздьями.
На жидкой питательной среде для стрептококков характерен придонный рост, при встряхивании разбивающейся на крупинки (хлопья) ; энтерококки и пневмококки дают диффузное помутнение. Стафилококки образуют слизистый осадок, который при встряхивании поднимается в виде косички, пленку, пристеночное кольцо.
В мазках из бульонных культур стрептококки располагаются в основном цепочками различной длины.
Дифференциация стрептококков. Дифференциацию культур стрептококков проводят по их чувствительности к желчи, способности расти в питательных средах с повышенным содержанием хлорида натрия и редуцировать метиленовый синий, а также по терморезистентности и ферментативным свойствам.
Лизис желчью. В две пробирки с глюкозосывороточным бульоном, в одну из которых добавлено 10 % желчи крупного рогатого скота, вносят по 0,5—0,7 см3 суточной бульонной культуры и выдерживают при 37 — 38 °С в течение 1 ч. При лизисе культуры содержимое подопытной пробирки просветляется.
Рост на среде с 40% желчи. Чистую культуру стрептококков засевают на глюкозосывороточный бульон, содержащий 40% желчи крупного рогатого скота, и инкубируют при 37—38 °С в течение 18 - 24 ч, после чего учитывают наличие или отсутствие роста.
Рост на среде с 6,5% хлорида натрия. Чистую культуру стрептококков засевают на глюкозосывороточный бульон, содержащий 6,5 % хлорида натрия. Учет результатов проводят через 18 — 24 ч инкубирования при 37—38 °С по наличию или отсутствию роста.
Редукция метиленового синего. Чистую культуру стрептококков засевают в пробирки с обезжиренным молоком, содержащим 0,1 % метиленового синего (среда имеет насыщенно-голубой цвет). Результаты учитывают через 18—24 ч инкубирования при 37 — 38°С. При редукций метиленового синего среда обесцвечивается и приобретает розовато-желтый цвет.
Терморезистентность. Пробирки с исследуемой суточной культурой, выращенной в глюкозо-сывороточном бульоне, прогревают в водяной бане при 58—60°С 30 мин, затем делают высевы на глюкозо-кровяной агар, которые выдерживают в термостате при 37 —38°С в течение 18—24 ч. Наличие роста культуры свидетельствует о ее терморезистентности.
Ферментативные свойства. Для определения ферментативных свойств выделенных культур стрептококков используют среды Гисса с раффинозой, сорбитом и маннитом. Посевы инкубируют при 37—38 °С в течение 5 сут, после чего проводят учет результатов.
Дифференциация энтерококков и пневмококков от стрептококков других серологических групп представлена в табл. 6.
Таб.6 Культурально-биохимические свойства стрептококков
| Наименование возбудителя | Гемолиз | Лизис желчью 1-% | Рост на среде с 40% желчи | Рост на среде с 6,5% хлорида натрия | Редукция метиленового синего | Термо- резистентность к 60°С 30 мин | Ферментация | ||
| Раффинозы | Сорбита | Маннита | |||||||
| Энтерококки (серогруппа Д) | альфа | - | + | + | + | + | - | + | + |
| Пневмококки | альфа | + | - | - | - | - | + | - | - |
| Стрептококки других серогрупп | бетта, гамма | - | - | - | - | - | - | - | - |
Обозначения: "+" - тест положительный; "-" - тест отрицательный.
При необходимости дифференцировать стрептококки от стафилококков используют каталазную пробу и способность стафилококков расти на средах, содержащих 10 % хлорида натрия (стрептококки при указанной концентрации хлорида натрия не растут).
Для постановки каталазной пробы на предметное стекло наносят каплю свеже-приготовленного 3 %-ного раствора Н202 и растирают в ней одну или несколько колоний; стафилококки в отличие от стрептококков образуют каталазу и вызывают пенообразование.
Постановка биологической пробы. Определение патогенных свойств стрептококков проводят на белых мышах массой 14 —16 г. Для заражения используют только свежевыделенные суточные культуры стрептококков с глюкозосывороточного бульона.
Заражают 3 белых мышей внутрибрюшинно дозой 0,5 см3. Наблюдение за подопытными животными ведут в течение 5 сут. При заражении патогенной культурой белые мыши гибнут, как правило, через 1 -2 сут.
Культуру признают патогенной при гибели не менее 2 белых мышей. Из спинного мозга, крови сердца, печени и селезенки каждой павшей мыши делают посевы на глюкозокровяной агар и глюкозосывороточный бульон для выделения исходной культуры. Срок исследования — до 7 дней.
Патогенность стафилококков определяют реакцией коагулирования плазмы крови. С этой целью ее разливают по 0,5 см3 в две стерильные пробирки, в одну из которых вносят петлей суточную агаровую культуру, другая остается контрольной;
обе пробирки помещают в термостат при температуре 37 °С. Результаты реакции коагуляции учитывают в течение 2-4 ч и через 24 ч. Штаммы стафилококка, продуцирующие фермент плазмокоагулазу, вызывают свертывание плазмы, вследствие чего она превращается в студнеобразную массу, не выливающуюся при перевертывании пробирки. Свертывание плазмы обозначается знаком "+" суказанием времени, в течение которого произошла реакция. При получении положительной реакции плазмокоагуляции считается, что в мясе обнаружен патогенный стафилококк.
Ветеринарно-санитарная оценка. При выделении кокковой микрофлоры из лимфатических узлов, глубоких слоев мускулатуры и внутренних органов туши при отсутствии патологических изменений в мышечной ткани обезвреживают действием высокой температуры (проваркой), а внутренние органы направляют в утилизацию.
При обнаружении кокковой микрофлоры в мышечной ткани и лимфатических узлов, при наличии дегенеративных изменений в мышцах или несвойственном им запахе, не исчезающем в пробе варкой, туши и продукты убоя утилизируют.
Мясо, полученное от убоя коров и овец, больных маститом, эндометритом, параметритом, подлежит кроме исследования на патогенные стафилококки проверке на сальмонеллы. При отсутствии сальмонелл и патогенных стафилококков, а также дегенеративных изменений в мускулатуре тушу и внутренние органы выпускают без ограничения. При наличии сальмонелл мясо подлежит проварке или переработке на колбасы и консервы, при выявлении стафилококков мясо направляют в проварку; пораженное вымя в том и другом случаях — на утилизацию.
При стафилококкозе птицы в случае поражения одного из суставов удаляют патологически измененную часть, а тушку выпускают после проварки. Если заболевание распространено (процессы в суставах, изменения в органах), тушку с органами утилизируют. При стрептококкозе тушку и внутренние органы утилизируют.